Comprendre l'énergie
La transition énergétique ambitionne d’affranchir les sociétés thermo-industrielles de leur dépendance aux énergies fossiles, grâce à un approvisionnement en d’autres formes d’énergie. Cette perspective présuppose qu’il n’existe aucun obstacle théorique ou technique à une telle substitution. Toutefois, si la physique a démontré que tout est énergie, le mystère de l’énergie implique aussi que toutes ses formes ne sont pas équivalentes, et que leur substitution est conditionnée.

La “nature” de l’énergie est inconnue. En physique, l’énergie est une quantité fondamentale, qui n’a pas de “sous composante”. L’humanité ne sait qu’une chose de l’énergie : elle permet les transformations.
L’énergie, c’est “ce qui permet”.
Sources
Source :
Richard P. Feynman, Robert B. Leighton, Matthew Sands, The Feynman Lectures on Physics, Addison-Wesley, 1970.
Page 93 de “Matter and Motion” :
Nous ne pouvons pas identifier une portion particulière d’énergie, ni la suivre à travers ses transformations. Elle n’a pas d’existence individuelle, comme celle que nous attribuons à des portions particulières de matière.
Les transactions de l’univers matériel semblent se dérouler, pour ainsi dire, selon un système de crédit. Chaque transaction consiste en un transfert d’une certaine quantité de crédit ou d’énergie d’un corps à un autre. Cet acte de transfert ou de paiement est appelé travail. L’énergie ainsi transférée ne conserve aucun caractère permettant de l’identifier lorsqu’elle passe d’une forme à une autre.
ARTICLE CX.- LA VALEUR ABSOLUE DE L’ÉNERGIE D’UN CORPS N’EST PAS CONNUE.
L’énergie d’un système matériel ne peut être estimée que de manière relative.
En premier lieu, bien que l’énergie du mouvement des parties par rapport au centre de masse du système puisse être définie avec précision, l’énergie totale consiste en cette énergie ainsi qu’en l’énergie d’une masse égale à celle du système entier se déplaçant à la vitesse du centre de masse. Or, cette dernière vitesse – celle du centre de masse – ne peut être estimée qu’en référence à un corps extérieur au système, et la valeur que nous attribuons à cette vitesse sera différente selon le corps que nous choisissons comme origine.
L’énergie cinétique estimée d’un système matériel contient donc une partie dont la valeur ne peut être déterminée que par le choix arbitraire d’une origine. La seule origine qui ne serait pas arbitraire est le centre de masse de l’univers matériel, mais c’est un point dont la position et le mouvement nous sont tout à fait inconnus.
ARTICLE CXI – L’ÉNERGIE LATENTE
Mais l’énergie d’un système matériel est indéterminée pour une autre raison. Nous ne pouvons pas réduire le système à un état dans lequel il n’a pas d’énergie, et toute énergie qui n’est jamais retirée du système doit rester imperceptible pour nous, car ce n’est qu’en entrant ou en sortant du système que nous pouvons en tenir compte.
Nous devons donc considérer l’énergie d’un système matériel comme une quantité dont nous pouvons déterminer l’augmentation ou la diminution lorsque le système passe d’un état défini à un autre. La valeur absolue de l’énergie dans l’état standard nous est inconnue, et elle ne nous serait d’aucune utilité si nous la connaissions, car tous les phénomènes dépendent des variations de l’énergie, et non de sa valeur absolue.
ARTICLE CXII – UNE DISCUSSION COMPLÈTE SUR L’ÉNERGIE INCLURAIT L’ENSEMBLE DE LA SCIENCE PHYSIQUE.
L’étude des diverses formes d’énergie, gravitationnelle, électromagnétique, moléculaire, thermique, etc., avec les conditions du transfert de l’énergie d’une forme à l’autre, et la dissipation constante de l’énergie disponible pour produire du travail, constitue l’ensemble de la science physique, dans la mesure où elle a été développée sous forme dynamique sous les diverses appellations d’astronomie, d’électricité, de magnétisme, d’optique, de théorie des états physiques des corps, de thermo-dynamique et de chimie.
We cannot identify a particular portion of energy, or trace it through its transformations. It has no individual existence, such as that which we attribute to particular portions of matter.
The transactions of the material universe appear to be conducted, as it were, on a system of credit. Each transaction consists of the transfer of so much credit or energy from one body to another. This act of transfer or payment is called work. The energy so transferred does not retain any character by which it can be identified when it passes from one form to another.
ARTICLE CX.—ABSOLUTE VALUE OF THE ENERGY OF A BODY UNKNOWN.
The energy of a material system can only be estimated in a relative manner.
In the first place, though the energy of the motion of the parts relative to the centre of mass ofThe system may be accurately defined, the whole energy consists of this together with the energy of a mass equal to that of the whole system moving with the velocity of the centre of mass. Now this latter velocity—that of the centre of mass—can be estimated only with reference to some body external to the system, and the value whieh we assign to this velocity will be different according to the body which we select as our origin.
Hence the estimated kinetic energy of a material system contains a part, the value of which cannot be determined except by the arbitrary selection of an origin. The only origin which would not be arbitrary is the centre of mass of the material universe, but this is a point the position and motion of which are quite unknown to us.
ARTICLE CXI.—LATENT ENERGY.
But the energy of a material system is indeterminate for another reason. We cannot reduce the system to a state in which it has no energy, and any energy which is never removed from the system must remain unperceived by us, for it is only as it enters or leaves the system that we can take any account of it.
We must, therefore, regard the energy of a material System as a quantity of which we may ascertain the increase or diminution as the system passes from one definite condition to another. The absolute value of the energy in the standard condition is unknown to us, and it would be of no value to us if we did know it, as all phenomena depend on the variations of the energy, and not on its absolute value.
ARTICLE CXII.—A COMPLETE DISCUSSION OF ENERGY WOULD INCLUDE THE WHOLE OF PHYSICAL SCIENCE.
The discussion of the various forms of energy—gravitational, electro-magnetic, molecular, thermal, &c.—with the conditions of the transference of energy from one form to another, and the constant dissipation of the energy available for producing work, constitutes tho whole of physical science, in so far as it bus been developed in the dynamical form under the various designations of Astronomy, Electricity, Magnetism, Optics, Theory of the Physical States of Bodies, Thermo-dynamics, and Chemistry.
Source :
Maxwell, J. (2010). Matter and Motion (Cambridge Library Collection – Physical Sciences). Cambridge: Cambridge University Press.
(…)
La tentative la plus élégante, et peut-être la dernière, d’exprimer tous les phénomènes naturels en termes de mouvement, est contenue dans la mécanique de Heinrich Hertz. La recherche d’une image uniforme du monde par la conception mécanique y trouve un achèvement quelque peu idéal. La mécanique de Hertz ne représente pas vraiment la physique telle qu’elle est, elle est la physique telle qu’elle pourrait être, une sorte de confession de foi pour la physique. Elle établit un programme de cohérence et d’harmonie majestueuses, un programme qui surpasse toutes les recherches antérieures orientées dans ce sens. Hertz ne se contente pas de postuler que toute la Nature, du point de vue mécanique, peut être complètement expliquée en supposant des mouvements de particules simples et semblables, qui constituent l’ensemble de l’univers physique. Il va plus loin que la conservation de la quantité de mouvement de Helmholtz, dans la mesure où il élimine d’emblée la différence entre l’énergie potentielle et l’énergie cinétique, et donc tous les problèmes impliquant l’étude de types particuliers d’énergie. Selon Hertz, il n’y a pas qu’une seule forme de matière, la particule, mais aussi une seule forme d’énergie, l’énergie cinétique. Toutes les autres formes d’énergie, telles que l’énergie potentielle, l’énergie électromagnétique, l’énergie chimique et l’énergie thermique, sont en réalité de l’énergie cinétique du mouvement de particules imperceptibles, et ces différentes formes sont simplement et uniquement dues à des relations naturelles entre les positions et les vitesses des particules considérées. Ces relations ne préjugent en rien de la validité du principe d’énergie, puisqu’elles n’affectent que les directions des mouvements et non les grandeurs des énergies cinétiques, de même que la direction d’un train est modifiée par la courbure des rails, mais non sa vitesse. Selon Hertz, tous les mouvements de la nature dépendent en fin de compte de l’inertie de la matière. Un bon exemple est fourni par la théorie cinétique des gaz, dans laquelle l’énergie élastique des particules de gaz stationnaires, jusqu’à présent considérée comme potentielle, est remplacée par l’énergie cinétique des particules de gaz en mouvement. Cette simplification radicale des postulats donne une simplicité et une lucidité merveilleuses aux théorèmes de la mécanique hertzienne.
(…)
The most elegant, and perhaps the final, attempt to express all natural phenomena in terms of motion, is contained in Heinrich Hertz’s mechanics. In this, the search of the mechanical conception for a uniform world picture has been brought to a somewhat ideal completion. Hertz’s mechanics does not really represent physics as it is, it is physics as it might be, a sort of confession of faith for physics. It draws up a programme of stately consistency and harmony, a programme surpassing all previous investigations directed to that end. Hertz is not satisfied with postulating that all Nature, from the mechanical [Page 32] point of view, can be completely explained by assuming movements of simple, similar particles, which build up the whole of the physical universe. He goes beyond Helmholtz’s conservation of momentum, in so far as he eliminates from the beginning the difference between potential and kinetic energy, and thereby all problems involving the investigation of special types of energy. According to Hertz, there is not only one form of matter, the particle, but also only one form of energy, kinetic. All other types of energy, such as potential energy, electromagnetic, chemical, and thermal energy, are really kinetic energy of the motion of imperceptible particles, and these different forms are simply and solely due to natural relations between the positions and velocities of the particles considered. These relations do not in any way prejudice the validity of the principle of energy, since they affect only the directions of the movements and not the magnitudes of the kinetic energies just as the direction of a train is altered by curvature of the rails, but not its speed. All movements in Nature, according to Hertz, depend ultimately on the inertia of matter. A good example is furnished by the kinetic theory of gases, in which the elastic energy of stationary gas particles hitherto considered as potential is replaced by the kinetic energy of moving gas particles. This radical simplification of the postulates gives a wonderful simplicity and lucidity to the theorems of Hertzian mechanics.
Source :
Max Planck, A Survey of Physical Theory, Dover Publication, 2011.
Toutes les transformations, tous les changements d’état sont issus d’un transfert d’énergie.
Sources
Qu’est-ce que la thermodynamique ?
La thermodynamique est une science qui traite de l’énergie, de sa transformation et de son équilibre. L’énergie est disponible sous plusieurs formes et se transforme d’une forme à l’autre lorsque la matière considérée interagit avec l’environnement. Au cours de cette interaction, l’état de la matière et ses propriétés changent et la matière échange de l’énergie sous forme de chaleur ou de travail, ou les deux, avec l’environnement. La thermodynamique établit un lien entre le changement d’état de la matière et l’énergie échangée sous forme de chaleur et de travail avec l’environnement. L’échange d’énergie ne peut avoir lieu au-delà d’un certain niveau et la matière atteint un état mort ou un état d’équilibre. La thermodynamique prédit l’état d’équilibre et dicte les limites au-delà desquelles un processus donné ne peut se dérouler dans des conditions spécifiques. En d’autres termes, la thermodynamique fournit un étalon pour comparer les processus. Supposons qu’un ingénieur conçoive un moteur thermique pour convertir en continu l’énergie de la matière en travail. La thermodynamique dicte l’efficacité maximale du moteur. La thermodynamique indique également si un processus donné – physique ou chimique – peut se dérouler spontanément ou non dans la direction spécifiée, dans les conditions données. En d’autres termes, elle prédit si un processus particulier est réalisable ou non dans les conditions spécifiées. La thermodynamique est donc un sujet très général qui trouve de nombreuses applications dans l’ingénierie chimique, mécanique, métallurgique et aérospatiale, ainsi que dans les domaines de la chimie et de la physique. La thermodynamique est née des efforts constants et continus de l’homme pour concevoir des moyens de convertir l’énergie possédée par la matière en travail. La thermodynamique a été formalisée au XIXe siècle par Joule, Clausius, Kelvin et Carnot. Plus tard, Gibbs en a fait une science d’une telle portée qu’elle est aujourd’hui utilisée dans toutes les branches de l’ingénierie et de la science.
Les principes de la thermodynamique peuvent être résumés sous la forme de quatre lois, connues sous le nom de loi zéro, première, deuxième et troisième loi de la thermodynamique. La loi zéro de la thermodynamique concerne l’équilibre thermique entre un ensemble de corps. Cette loi est à la base de la mesure de la température. La première loi de la thermodynamique établit un lien entre les changements d’énergie de la matière considérée et l’énergie échangée sous forme de chaleur et de travail avec son environnement. Cette loi est également connue sous le nom de principe de conservation de l’énergie. La première loi de la thermodynamique est d’une application beaucoup plus large que le principe de conservation de l’énergie proposé par Leibnitz, qui ne s’applique qu’aux systèmes mécaniques. La première loi de la thermodynamique conduit au concept d’énergie interne. La deuxième loi de la thermodynamique dicte la limite jusqu’à laquelle l’énergie possédée par la matière peut être convertie en travail et fournit ainsi un moyen de comparer les performances de plusieurs dispositifs et processus. Cette loi exclut qu’un processus spontané puisse s’inverser de lui-même. En d’autres termes, la deuxième loi de la thermodynamique indique la direction dans laquelle un processus se déroule et fournit des informations sur la faisabilité d’un processus. La deuxième loi de la thermodynamique introduit également le concept d’entropie et indique que l’entropie de l’univers ne peut jamais diminuer. Cette loi est également connue sous le nom de principe d’augmentation de l’entropie. Enfin, la troisième loi de la thermodynamique définit le zéro absolu de l’entropie, ce qui permet de l’estimer en quantités absolues.
Ces lois de la thermodynamique sont basées sur un grand nombre d’observations expérimentales et ont été déduites par un raisonnement logique. Les lois de la thermodynamique ne peuvent pas être prouvées comme on prouve les théorèmes mathématiques. La validité de ces lois repose sur la concordance entre les résultats expérimentaux et les prédictions faites sur la base de ces lois. Jusqu’à présent, aucune preuve expérimentale ne permet de mettre en doute la validité de ces lois.
What is thermodynamics ?
Themodynamics is a science dealing with energy and its transformation and equilibrium. Energy is available in several forms and it transforms from one form to the other when the material under consideration interacts with the surroundings. During this interaction, the state of the matter and its properties change and the matter exchanges energy either as heat or work or both with the surroundings. Thermodynamics relates the change in the state of the matter to the energy exchanged as heat and work with the surroundings. The exchange of energy cannot take place beyond a certain extent and the matter reaches a dead state or equilibrium state. Thermodynamics predicts the state of equilibrium and dictates the limits beyond which a given process at specified conditions cannot proceed. In other words, thermodynamics provides a yardstick to compare the processes. Suppose an engineer is devising a heat engine to continuously convert the energy possessed by the matter into work. Thermodynamics dictates the maximum efficiency of the engine. Thermodynamics also tells whether a given process – physical or chemical – can spontaneously proceed or not in the specified direction, at the given conditions. That is, it predicts whether a particular process is feasible or not at the specified conditions. Thus, thermodynamics is a subject of great generality and finds wide applications in chemical, mechanical, metallurgical and aerospace engineering in addition to the fields of chemistry and physics. Thermodynamics originated as a result of man’s constant and continuous effort to devise means of converting the energy possessed by matter into work. Thermodynamics was formalized in the nineteenth century by Joule, Clausius, Kelvin and Carnot. Later Gibbs developed it into a science of such a broad scope that nowadays it is used in all branches of engineering and science.
The principles of thermodynamics can be summarized in the form of four laws, known as the zeroth, first, second and third laws of thermodynamics. The zeroth law or thermodynamics is about thermal equilibrium between a set of bodies. This law forms the basis for the measurement of temperature. The first law of thermodynamics relates the changes in the energy of matter under consideration with the energy exchanged as heat and work with its surroundings. This law is also known as the principle of conservation of energy. The first law of thermodynamics is of much wider applicability than the principle of conservation of energy proposed by Leibnitz, which is applicable to mechanical systems only. The first law of thermodynamics leads to the concept of internal energy. The second law of thermodynamics dictates the limit to which the energy possessed by matter can be converted into work and thus provides a means of comparing the performance of several devices and processes. This law rules out the possibility of a spontaneous process reversing on its own. That is, the second law of thermodynamics tells about the direction in which a process proceeds and provides information regarding the feasibility of a process. The second law of thermodynamics also introduces the concept of entropy and tells that the entropy of the universe can never decrease. This law is also known as the principle of entropy increase. Finally, the third law of thermodynamics defines the absolute zero of entropy, thus providing a means of estimating it in absolute quantities.
These laws of thermodynamics are based on a large number of experimental observations and were deduced through logical reasoning. The laws of thermodynamics cannot be proved the way we prove mathematical theorems. The validity of these laws rests upon the agreement between the experimental results and the predictions made on the basis of these laws. So far no experimental evidence is available to doubt the validity of these laws.
Source :
Y. V. C. Rao, Chemical Engineering Thermodynamics, Universities Press, 1997.


L’énergie se présente sous différentes formes :
- Potentielle : énergie due à la position relative des corps, convertible en énergie cinétique
- Cinétique : énergie d’un corps en mouvement
- Mécanique : somme de l’énergie cinétique et potentielle d’un système
- Électrique : issue du mouvement des électrons
- Électromagnétique (radiative) : issue du mouvement des photons
- Thermique : issue du mouvement des atomes et des molécules
- Chimique : associée aux liaisons entre les atomes des molécules
- Nucléaire : associée à la force de cohésion des nucléons au cœur des noyaux atomiques
Sources
Page 62 de “On the Mechanical Equivalent of Heat” :
Mes propres expériences sur ce sujet ont commencé en 1840, année où j’ai communiqué à la Société Royale ma découverte de la loi de la chaleur dégagée par l’électricité voltaïque, loi dont j’ai tiré les déductions immédiates : premièrement, que la chaleur dégagée par toute paire voltaïque est proportionnelle, caeteris paribus, à son intensité ou force électromotrice* ; et deuxièmement, que la chaleur dégagée par la combustion d’un corps est proportionnelle à l’intensité de son affinité pour l’oxygent. Je réussis ainsi à établir des relations entre la chaleur et l’affinité chimique. En 1843, j’ai montré que la chaleur dégagée par la magnétoélectricité est proportionnelle à la force absorbée ; et que la force du moteur électromagnétique est dérivée de la force de l’affinité chimique dans la pile, force qui autrement serait dégagée sous forme de chaleur : d’après ces faits, je me suis estimé fondé à annoncer “que la quantité de chaleur capable d’augmenter la température d’une livre d’eau d’un degré sur l’échelle de FAHRENHEIT, est égale et peut être convertie en une force mécanique capable d’élever 838 livres à la hauteur perpendiculaire d’un pied”.
Dans un article ultérieur, présenté à la Société royale en 1844, je me suis efforcé de montrer que la chaleur absorbée et produite par la raréfaction et la condensation de l’air est proportionnelle à la force produite et absorbée dans ces opérations. La relation quantitative entre la force et la chaleur déduite de ces expériences est presque identique à celle qui résulte des expériences électro-magnétiques dont il vient d’être question, et elle est confirmée par les expériences de M. SEGUIN sur la dilatation de la vapeur.
(…)
Des résultats coïncidant si étroitement les uns avec les autres, et avec ceux obtenus précédemment par des expériences sur les fluides élastiques et la machine électro-magnétique, ne laissaient aucun doute dans mon esprit quant à l’existence d’une relation équivalente entre la force et la chaleur ; mais il me paraissait néanmoins de la plus haute importance d’obtenir cette relation avec une précision encore plus grande. C’est ce que j’ai tenté de faire dans le présent document.
My own experiments in reference to the subject were commenced in 1840, in which year I communicated to the Royal Society my discovery of the law of the heat evolved by voltaic electricity, a law from which the immediate deductions were drawn, -1st, that the heat evolved by any voltaic pair is proportional, caeteris paribus, to its intensity or electromotive force; and 2nd, that the heat evolved by the combustion of a body is proportional to the intensity of its affinity for oxygen. I thus succeeded in establishing relations between heat and chemical affinity. In 1843 I showed that the heat evolved by magneto-electricity is proportional to the force absorbed; and that the force of the electromagnetic engine is derived from the force of chemicals affinity in the battery, a force which otherwise would be evolved in the form of heat: from these facts I considered myself justified in announcing “that the quantity of heat capable of increasing the temperature of a lb. of water by one degree of FAHRENHEIT’S scale, is equal to, and may be converted into, a mechanical force capable of raising 838 lbs. to the perpendicular height of one foot.”
In a subsequent paper, read before the Royal Society in 1844, I endeavoured to show that the heat absorbed and evolved by the rarefaction and condensation of air is proportional to the force evolved and absorbed in those operations. The quantitative relation between force and heat deduced from these experiments, is almost identical with that derived from the electro-magnetic experiments just referred to, and is confirmed by the experiments of M. SEGUIN on the dilatation of steam.
(…)
Results so closely coinciding with one another, and with those previously derived from experiments with elastic fluids and the electro-magnetic machine, left no doubt on my mind as to the existence of an equivalent relation between force and heat; but still it appeared of the highest importance to obtain that relation with still greater accuracy. This I have attempted in the present paper.
Source :
Joule James Prescott 1851 On the mechanical equivalent of heat. Proc. R. Soc. Lond.5839
Pages 50 à 54 de “The Evolution of Physics” :
Il s’agit maintenant de quelque chose de plus que les énergies cinétique et potentielle, à savoir la chaleur créée par le frottement. Cette chaleur correspond-elle à la diminution de l’énergie mécanique, c’est-à-dire de l’énergie cinétique et de l’énergie potentielle ? Une nouvelle hypothèse est imminente. Si la chaleur peut être considérée comme une forme d’énergie, peut-être que la somme des trois énergies – chaleur, cinétique et potentielle – reste constante. Non pas la chaleur seule, mais la chaleur et les autres formes d’énergie prises ensemble sont, comme une substance, indestructibles. C’est comme si un homme devait se payer une commission en francs pour changer des dollars en livres, l’argent de la commission étant également épargné de sorte que la somme des dollars, des livres et des francs soit un montant fixe selon un taux de change défini.
Les progrès de la science ont détruit l’ancien concept de la chaleur en tant que substance. Nous essayons de créer une nouvelle substance, l’énergie, dont la chaleur est l’une des formes.
LE TAUX DE CHANGE
Il y a moins de cent ans, le nouvel indice qui a conduit au concept de la chaleur comme forme d’énergie a été deviné par Mayer et confirmé expérimentalement par Joule. C’est une étrange coïncidence que presque tous les travaux fondamentaux concernant la nature de la chaleur aient été réalisés par des physiciens non professionnels qui considéraient la physique comme un simple passe-temps. Il y avait l’Écossais polyvalent Black, le médecin allemand Mayer et le grand aventurier américain Count Rumford, qui a ensuite vécu en Europe et est devenu, entre autres, ministre de la guerre de Bavière. Il y avait aussi le brasseur anglais Joule qui, pendant son temps libre, a réalisé des expériences très importantes sur la conservation de l’énergie.
Joule a vérifié par l’expérience l’hypothèse selon laquelle la chaleur est une forme d’énergie et a déterminé le taux de change. Il vaut la peine de voir quels ont été ses résultats.
L’énergie cinétique et l’énergie potentielle d’un système constituent ensemble son énergie mécanique. Dans le cas de l’aiguillage, nous avons supposé qu’une partie de l’énergie mécanique était convertie en chaleur. Si cela est vrai, il doit y avoir ici et dans tous les autres processus physiques similaires un taux de change défini entre les deux. Il s’agit rigoureusement d’une question quantitative, mais le fait qu’une quantité donnée d’énergie mécanique puisse être transformée en une quantité définie de chaleur est extrêmement important. Nous aimerions savoir quel nombre exprime le taux de change, c’est-à-dire la quantité de chaleur que nous obtenons à partir d’une quantité donnée d’énergie mécanique.
(…)
Une fois ce travail important accompli, les progrès ont été rapides. Il fut rapidement reconnu que ces types d’énergie, mécanique et thermique, ne sont que deux de ses nombreuses formes. Tout ce qui peut être converti en l’une ou l’autre de ces formes d’énergie est également une forme d’énergie. Le rayonnement du soleil est de l’énergie, car une partie est transformée en chaleur sur la terre. Un courant électrique possède de l’énergie, car il chauffe un fil ou fait tourner les roues d’un moteur. Le charbon représente de l’énergie chimique, libérée sous forme de chaleur lorsque le charbon brûle. Dans chaque événement de la nature, une forme d’énergie est convertie en une autre, toujours à un taux de change bien défini. Dans un système fermé, isolé des influences extérieures, l’énergie est conservée et se comporte donc comme une substance. La somme de toutes les formes d’énergie possibles dans un tel système est constante, même si la quantité de l’une d’entre elles peut varier. Si nous considérons l’univers entier comme un système fermé, nous pouvons fièrement annoncer, avec les physiciens du XIXe siècle, que l’énergie de l’univers est invariante, qu’aucune partie ne peut jamais être créée ou détruite.
Pages 89 et 90 :
[Étude du fonctionnement d’une batterie]
Pour tenter de sauver la théorie des fluides, on peut supposer qu’une force constante agit pour régénérer la différence de potentiel et provoquer un écoulement de fluide électrique. Mais l’ensemble du phénomène est étonnant du point de vue de l’énergie. Une quantité notable de chaleur est générée dans le fil qui transporte le courant, suffisamment même pour faire fondre le fil s’il est fin. Il y a donc création d’énergie thermique dans le fil. Mais l’ensemble de la pile voltaïque forme un système isolé, puisqu’aucune énergie extérieure n’est fournie. Si nous voulons sauver la loi de conservation de l’énergie, nous devons trouver où les transformations ont lieu et à quel prix la chaleur est créée.
Il n’est pas difficile de se rendre compte que des processus chimiques complexes ont lieu dans la pile, processus dans lesquels le cuivre et le zinc immergés, ainsi que le liquide lui-même, jouent un rôle actif. Du point de vue de l’énergie, voici la chaîne de transformations qui se produit : énergie chimique à énergie du fluide électrique qui circule, c’est-à-dire le courant à chaleur. Une pile voltaïque ne dure pas éternellement ; les changements chimiques associés au flux d’électricité rendent la pile inutilisable au bout d’un certain temps. L’expérience qui a révélé les grandes difficultés d’application des idées de la mécanique doit sembler étrange à ceux qui l’entendent pour la première fois.
Something more than kinetic and potential energies is now involved, namely, the heat created by friction. Does this heat correspond to the diminution in mechanical energy, that is kinetic and potential energy? A new guess is imminent. If heat may be regarded as a form of energy, perhaps the sum of all three—heat, kinetic and potential energies—remains constant. Not heat alone, but heat and other forms of energy taken together are, like a substanc51e, indestructible. It is as if a man must pay himself a commission in francs for changing dollars to pounds, the commission money also being saved so that the sum of dollars, pounds, and francs is a fixed amount according to some definite exchange rate.
The progress of science has destroyed the older concept of heat as a substance. We try to create a new substance, energy, with heat as one of its forms.
THE RATE OF EXCHANGE
Less than a hundred years ago the new clue which led to the concept of heat as a form of energy was guessed by Mayer and confirmed experimentally by Joule. It is a strange coincidence that nearly all the fundamental work concerned with the nature of heat was done by non-professional physicists who regarded physics merely as their great hobby. There was the versatile Scotsman Black, the German physician Mayer, and the great American adventurer Count Rumford, who afterwards lived in Europe and, among other activities, became Minister of War for Bavaria. There was also the English brewer Joule who, in his spare time, performed some most important experiments concerning the conservation of energy.
Joule verified by experiment the guess that heat is a form of energy, and determined the rate of exchange. It is worth our while to see just what his results were.
The kinetic and potential energy of a system together constitute its mechanical energy. In the case of the switchback we made a guess that some of the mechanical energy was converted into heat. If this is right, there must be here and in all other similar physical processes a definite rate of exchange between the two. This is rigorously a quantitative question, but the fact that a given quantity of mechanical energy can be changed into a definite amount of heat is highly important. We should like to know what number expresses the rate of exchange, i.e., how much heat we obtain from a given amount of mechanical energy.
(…)
Once this important work was done, further progress was rapid. It was soon recognized that these kinds of energy, mechanical and heat, are only two of its many forms. Everything which can be converted into either of them is also a form of energy. The radiation given off by the sun is energy, for part of it is transformed into heat on the earth. An electric current possesses energy, for it heats a wire or turns the wheels of a motor. Coal represents chemical energy, liberated as heat when the coal burns. In every event in nature one form of energy is being converted into another, always at some well-defined rate of exchange. In a closed system, one isolated from external influences, the energy is conserved and thus behaves like a substance. The sum of all possible forms of energy in such a system is constant, although the amount of any one kind may be changing. If we regard the whole universe as a closed system, we can proudly announce with the physicists of the nineteenth century that the energy of the universe is invariant, that no part of it can ever be created or destroyed.
Pages 89 et 90 :
In an attempt to save the fluid theory, we may assume that some constant force acts to regenerate the potential difference and cause a flow of electric fluid. But the whole phenomenon is astonishing from the standpoint of energy. A noticeable quantity of heat is generated in the wire carrying the current, even enough to melt the wire if it is a thin one. Therefore, heat-energy is created in the wire. But the whole voltaic battery forms an isolated system, since no external energy is being supplied. If we want to save the law of conservation of energy we must find where the transformations take place, and at what expense the heat is created. It is not difficult to realize that complicated chemical processes are taking place in the battery, processes in which the immersed copper and zinc, as well as the liquid itself, take active parts. From the standpoint of energy this is the chain of transformations which are taking place: chemical energy->energy of the flowing electric fluid, i.e., the current->heat. A voltaic battery does not last for ever; the chemical changes associated with the flow of electricity make the battery useless after a time.
The experiment which actually revealed the great difficulties in applying the mechanical ideas must sound strange to anyone hearing about it for the first time.
Source :
Albert Einstein, The Evolution of physics, Touchstone, 1967
Il est important de réaliser que dans la physique d’aujourd’hui, nous n’avons aucune connaissance de ce qu’est l’énergie. Nous n’avons pas de représentation comme quoi l’énergie viendrait en petits paquets d’une certaine quantité. Ce n’est pas ainsi. Cependant des formules permettent de calculer une certaine quantité numérique et lorsque nous les ajoutons toutes ensemble, cela donne “28” — toujours le même nombre. C’est une chose abstraite en cela qu’elle ne nous donne pas le mécanisme ou les raisons des diverses formules.
(…)
La conservation de l’énergie ne peut être comprise que si nous avons la formule pour toutes ses formes.
(…)
À partir de notre discussion, il est évident que la loi de conservation de l’énergie est extrêmement utile pour analyser les phénomènes sans connaître toutes les formules, comme nous l’avons illustré par quelques exemples. Si nous disposions des formules pour toutes les sortes d’énergie, nous pourrions analyser comment de nombreux processus doivent fonctionner sans avoir à entrer dans les détails.
(…)
Par rapport à la conservation de l’énergie, nous devrions remarquer que l’énergie disponible est un autre problème — les atomes de l’eau de mer s’agitent beaucoup parce que la mer est à une certaine température, mais il est impossible de les faire aller ensemble dans un mouvement défini sans prendre de l’énergie en un autre endroit. C’est dire que malgré la conservation de l’énergie, l’énergie disponible pour l’utilisation humaine n’est pas conservée si facilement. Les lois qui gouvernent la disponibilité d’énergie sont appelées les lois de la thermodynamique, et introduisent un concept appelé l’entropie pour les processus thermodynamiques irréversibles.
It is important to realize that in physics today, we have no knowledge of what energy is. We do not have a picture that energy comes in little blobs of a definite amount. It is not that way. However, there are formulas for calculating some numerical quantity, and when we add it all together it gives “28”—always the same number. It is an abstract thing in that it does not tell us the mechanism or the reasons for the various formulas.
(…)
Conservation of energy can be understood only if we have the formula for all of its forms.
(…)
It is obvious from our discussion that the law of conservation of energy is enormously useful in making analyses, as we have illustrated in a few examples without knowing all the formulas. If we had all the formulas for all kinds of energy, we could analyze how many processes should work without having to go into the details.
(…)
With regard to the conservation of energy, we should note that available energy is another matter—there is a lot of jiggling around in the atoms of the water of the sea, because the sea has a certain temperature, but it is impossible to get them herded into a definite motion without taking energy from somewhere else. That is, although we know for a fact that energy is conserved, the energy available for human utility is not conserved so easily. The laws which govern how much energy is available are called the laws of thermodynamics and involve a concept called entropy for irreversible thermodynamic processes.
Source :
Richard P. Feynman, Robert B. Leighton, Matthew Sands, The Feynman Lectures on Physics, Addison-Wesley, 1970.
Page 11 et 12 de “Modern Thermodynamics. From Heat Engines to Dissipative Structures” :
(…)
La chaleur a d’abord été considérée comme une substance indestructible appelée calorique. Selon cette conception, le calorique, fluide sans masse, passait d’un corps à l’autre en provoquant des changements de température. Cependant, au XIXe siècle, il a été établi que la chaleur n’était pas une substance calorique indestructible, mais une forme d’énergie qui peut se convertir en d’autres formes d’énergie. C’est pourquoi la chaleur est mesurée en unités d’énergie.
Page 47 :
La véritable nature de la chaleur en tant que forme d’énergie pouvant se convertir en d’autres formes d’énergie a été établie après de nombreux débats. L’une des démonstrations les plus spectaculaires de la conversion de l’énergie mécanique en chaleur a été réalisée par Benjamin Thompson, un Américain né à Woburn, dans le Massachusetts, dont la vie aventureuse l’a conduit en Bavière où il est devenu le comte Rumford (1753-1814) [4]. Rumford immerge des cylindres métalliques dans l’eau et y perce des trous. La chaleur produite par le frottement mécanique pouvait faire bouillir l’eau ! Il a même estimé que la production d’une cal de chaleur nécessite environ 5,5 J de travail mécanique [5].
Ce sont les résultats des expériences minutieuses de James Prescott Joule, rapportés en 1847, qui ont établi sans l’ombre d’un doute que la chaleur n’était pas une substance indestructible, qu’elle pouvait en fait être transformée en énergie mécanique et vice versa [5, 6]. En outre, Joule a montré qu’il existe une équivalence entre la chaleur et l’énergie mécanique dans le sens suivant : une certaine quantité d’énergie mécanique, quel que soit le moyen de conversion, produit toujours la même quantité de chaleur (4,184 J produisent 1 cal de chaleur). Cela signifie que la chaleur et l’énergie mécanique peuvent être considérées comme des manifestations différentes d’une même quantité physique, l'”énergie”.
Page 50 :
Avec l’établissement de l’équivalence mécanique de la chaleur par Joule, il est devenu admis que la chaleur est une forme d’énergie qui peut être convertie en travail et vice versa. C’est dans la seconde moitié du XIXe siècle que le concept de conservation de l’énergie a été clairement formulé.
(…)
Heat was initially thought to be an indestructible substance called the caloric. According to this view, caloric, a fluid without mass, passed from one body to another, causing changes in temperature. However, in the nineteenth century it was established that heat was not an indestructible caloric but a form of energy that can convert to other forms of energy. Hence, heat is measured in the units of energy.
Page 47 :
The true nature of heat as a form of energy that can interconvert to other forms of energy was established after much debate. One of the most dramatic demonstrations of the conversion of mechanical energy to heat was performed by Benjamin Thompson, an American born inWoburn, Massachusetts, whose adventurous life took him to Bavaria where he became Count Rumford (1753–1814) [4]. Rumford immersed metal cylinders in water and drilled holes in them. The heat produced due to mechanical friction could bring the water to a boil! He even estimated that the production of 1 cal of heat requires about 5.5 J of mechanical work [5]. It was the results of the careful experiments of James Prescott Joule, reported in 1847, that established beyond doubt that heat was not an indestructible substance, that, in fact, it can be transformed to mechanical energy and vice versa [5, 6]. Furthermore, Joule showed that there is an equivalence between heat and mechanical energy in the following sense: a certain amount of mechanical energy, regardless of the particular means of conversion, always produces the same amount of heat (4.184 J produce 1 cal of heat). This meant heat and mechanical energy can be thought of as different manifestations of the same physical quantity, the ‘energy’.
Page 50 :
With the establishment of the mechanical equivalence of heat by Joule, it became accepted that heat is a form of energy that could be converted to work and vice versa. It was in the second half of the nineteenth century that the concept of conservation of energy was clearly formulated.
Source :
Ilya Prigogine, Dilip Kondepudi, Modern Thermodynamics. From Heat Engines to Dissipative Structures, Odile Jacob, 1999.
Source :
Jo Hermans, L’Énergie sous toutes ses formes, Tome 1, EDP Sciences, 2014.
Page 42 de “Reality ans its order” :
Le développement de la théorie de l’électricité est à l’origine de la première avancée décisive de la physique classique au-delà de la mécanique newtonienne. Les forces particulières qui s’exercent entre des corps chargés électriquement, ou magnétiques, sont l’objet de cette discipline. En même temps, elle permet une analyse assez générale du concept de force, qui était il y a encore peu de temps étranger à la physique newtonienne. Dans la théorie de l’électricité, la force est objectivée et fixée dans l’espace et le temps par le concept de “champ de force”, de la même manière que la matière est objectivée et fixée en mécanique. La force n’apparaît pas seulement comme un effet d’un corps sur un autre, mais elle est elle-même un processus dans l’espace et le temps qui peut se détacher complètement de toute matière. Comprendre l’autonomie de la force permet de clarifier la relation intrinsèque entre la force et la matière, qui a fini par s’exprimer le plus clairement dans les lois naturelles qui n’ont été découvertes qu’au début du XXe siècle, dans le cadre de la théorie de la relativité restreinte. Dans la perspective de ce que nous savons aujourd’hui, il ne semble pas anormal, par exemple, de parler du rayonnement, c’est-à-dire du champ de force électromagnétique, comme d’une forme particulière de la matière. La matière peut se transformer en rayonnement et le rayonnement en matière. Le principe de la conservation de la matière est élargi à celui de la conservation de l’énergie, et l’énergie peut se présenter sous les formes les plus diverses : rayonnement, mouvement, poids.
The development of the theory of electricity was responsible for the first decisive step forward in classical physics beyond Newtonian mechanics. The particular forces that are present between electrically charged or magnetic bodies are the object of this discipline. At the same time, it enables a quite general analysis of the concept of force which was still somewhat alien to Newtonian physics. In the theory of electricity, force is objectified and fixed in space and time by the concept of the “force field” in a manner similar to the way matter is objectified and fixed in mechanics. Force appears not only as an effect of one body on another, but is itself a process in space and time that can detach itself completely from all matter. Understanding the autonomy of force helps clarify the intrinsic relationship between force and matter which were eventually most clearly articulated in the natural laws that were discovered only at the beginning of the twentieth century in connection with the special theory of relativity. From the perspective of what we know today, it does not appear anomalous, for example, to speak of radiation, that is, the electromagnetic force field, as a special form of matter. Matter can change into radiation and radiation into matter. The principle about the conservation of matter is expanded into one about the conservation of energy, and energy can present itself in the most diverse forms: as radiation, motion, weight.
Source :
Werner Heisenberg, Reality and its order, Springer Cham, 2019. https://doi.org/10.1007/978-3-030-25696-8
Essai rédigé entre 1941 et 1942
Page 77 de “Matter and Motion” :
Or, puisque la chaleur peut être produite, elle ne peut être une substance ; et puisque chaque fois qu’il y a perte d’énergie mécanique par frottement, il y a production de chaleur, et que chaque fois qu’il y a gain d’énergie mécanique dans un moteur, il y a perte de chaleur ; et puisque la quantité d’énergie perdue ou gagnée est proportionnelle à la quantité de chaleur gagnée ou perdue, nous en concluons que la chaleur est une forme d’énergie.
Nous avons également des raisons de penser que les minuscules particules d’un corps chaud sont dans un état d’agitation rapide, c’est-à-dire que chaque particule se déplace toujours très rapidement, mais que la direction de son mouvement change si souvent qu’elle progresse peu ou pas du tout d’une région à l’autre.
Si tel est le cas, une partie, et peut-être une très grande partie, de l’énergie d’un corps chaud doit être sous forme d’énergie cinétique.
Mais pour notre propos actuel, il n’est pas nécessaire de savoir sous quelle forme l’énergie existe dans un corps chaud ; le fait le plus important est que l’énergie peut être mesurée sous forme de chaleur, et comme toute forme d’énergie peut être convertie en chaleur, cela nous donne une des méthodes les plus commodes pour la mesurer.
Now, since heat can be produced it cannot be a substance; and since whenever mechanical energy is lost by friction there is a production of heat, and whenever there is a gain of mechanical energy in an engine there is a loss of heat; and since the quantity of energy lost or gained is proportional to the quantity of heat gained or lost, we conclude that heat is a form of energy.
We have also reasons for believing that the minute particles of a hot body are in a state of rapid agitation, that is to say, that each particle is always moving very swiftly, but that the direction of its motion alters so often that it makes little or no progress from one region to another.
If this be the case, a part, and it may be a very large part, of the energy of a hot body must be in the form of kinetic energy.
But for our present purpose it is unnecessary to ascertain in what form energy exists in a hot body; the most important fact is that energy may be measured in the form of heat, and since every kind of energy may be converted into heat, this gives us one of the most convenient methods of measuring it.
Source :
Maxwell, J. (2010). Matter and Motion (Cambridge Library Collection – Physical Sciences). Cambridge: Cambridge University Press. doi:10.1017/CBO9780511709326
Parmi les termes proportionnels aux carrés des vitesses, comment discerner ceux qui proviennent de T ou de U ? Comment, par conséquent, distinguer les deux parties de l’énergie ?
Mais il y a plus, Comment définir l’énergie elle-même ? Nous n’avons plus aucune raison de prendre comme définition T + U plutôt que toute autre fonction de T + U, quand a disparu la propriété qui caractérisait T + U, celle d’être la somme de deux termes d’une forme particulière.
Mais ce n’est pas tout, il faut tenir compte, non seulement de l’énergie mécanique proprement dite, mais des autres formes de l’énergie, chaleur, énergie chimique, énergie électrique, etc. Le principe de la conservation de l’énergie doit s’écrire :
T + U + Q = const.
où T représenterait l’énergie cinétique sensible, U l’énergie potentielle de position, dépendant seulement de la position des corps, Q l’énergie interne moléculaire, sous la forme thermique, chimique ou électrique.
Tout irait bien si ces trois termes étaient absolument distincts, si T était proportionnel au carré des vitesses, U indépendant de ces vitesses et de l’état des corps, Q indépendant des vitesses et des positions des corps et dépendant seulement de leur état interne.
L’expression de l’énergie ne pourrait se décomposer que d’une seule manière en trois termes de cette forme.
Mais il n’en est pas ainsi ; considérons des corps électrisés : l’énergie électrostatique due à leur action mutuelle dépendra évidemment de leur charge, c’est-à-dire de leur état ; mais elle dépendra également de leur position. Si ces corps sont en mouvement, ils agiront l’un sur l’autre électrodynamiquement et l’énergie électrodynamique dépendra non seulement de leur état et de leur position, mais de leurs vitesses.
Nous n’avons donc plus aucun moyen de faire le triage des termes qui doivent faire partie de T, de U et de Q et de séparer les trois parties de l’énergie.
Si (T + U + Q) est constant, il en est de même d’une fonction quelconque.
φ(T + U + Q).
Si T + U + Q était de la forme particulière que j’ai envisagée plus haut, il n’en résulterait pas d’ambiguïté ; parmi les fonctions φ(T + U + Q) qui demeurent constantes, il n’y en aurait qu’une qui serait de cette forme particulière, et ce serait celle-là que je conviendrais d’appeler énergie.
Mais je l’ai dit, il n’en est pas rigoureusement ainsi ; parmi les fonctions qui demeurent constantes, il n’y en a pas qui puissent rigoureusement se mettre sous cette forme particulière ; dès lors, comment choisir parmi elles celle qui doit s’appeler l’énergie ? Nous n’avons plus rien qui puisse nous guider dans notre choix.
Il ne nous reste plus qu’un énoncé pour le principe de la conservation de l’énergie ; il y a quelque chose qui demeure constant. Sous cette forme, il se trouve à son tour hors des atteintes de l’expérience et se réduit à une sorte de tautologie. Il est clair que si le monde est gouverné par des lois, il y aura des quantités qui demeureront constantes. Comme les principes de Newton, et pour une raison analogue, le principe de la conservation de l’énergie, fondé sur l’expérience, ne pourrait plus être infirmé par elle.
Cette discussion montre qu’en passant du système classique au système énergétique, on a réalisé un progrès ; mais elle montre, en même temps, que ce progrès est insuffisant.
Une autre objection me semble encore plus grave : le principe de moindre action est applicable aux phénomènes réversibles ; mais il n’est nullement satisfaisant en ce qui concerne les phénomènes irréversibles ; la tentative de Helmholtz pour l’étendre à ce genre de phénomènes n’a pas réussi et ne pouvait réussir : sous ce rapport tout reste à faire.
L’énoncé même du principe de moindre action a quelque chose de choquant pour l’esprit. Pour se rendre d’un point à un autre, une molécule matérielle, soustraite à l’action de toute force, mais assujettie à se mouvoir sur une surface, prendra la ligne géodésique, c’est-à-dire le chemin le plus court.
Cette molécule semble connaître le point où on veut la mener, prévoir le temps qu’elle mettra à l’atteindre en suivant tel et tel chemin, et choisir ensuite le chemin le plus convenable. L’énoncé nous la présente pour ainsi dire comme un être animé et libre. Il est clair qu’il vaudrait mieux le remplacer par un énoncé moins choquant, et où, comme diraient les philosophes, les causes finales ne sembleraient pas se substituer aux causes efficientes.
Source :
Henri Poincaré, La Science et l’hypothèse, Flammarion, 2014.
L’énergie est partout, mais ne se présente pas toujours sous une forme autorisant des transformations.
L’humanité ne produit pas l’énergie dont elle a besoin. Quand elle en a les capacités, et lorsque l’énergie est disponible, elle la capture dans son milieu. Toutes les formes d’énergie ne sont pas exploitables, ou pas de la même façon, par l’humanité.
Sources
Page 9 de “Principles of thermodynamics” :
La thermodynamique repose sur deux lois fondamentales. Leur justification repose sur la validité empirique de leurs implications. Dans ce chapitre, nous examinons la première loi. Nous présenterons la deuxième loi au chapitre 2.
La première loi de la thermodynamique stipule que :
Pour chaque système, il existe une fonction d’état extensive scalaire appelée énergie (E). Lorsque le système est isolé, l’énergie est conservée.
La loi de conservation de l’énergie s’écrit mathématiquement comme suit : E˙ = 0 (système isolé) (1.9) où E˙ ≡ dE/dt. Cette conservation est liée à l’homogénéité temporelle [9]. Elle implique que l’énergie est définie jusqu’à une constante.
Lorsque le système interagit avec son environnement, l’évolution de l’énergie résulte de de la puissance des processus exercés sur le système. On distingue quatre types de processus externes et écrivons [10] :
E˙ = Pext + PW + PQ + PC (système ouvert) (1.10)
– Pext représente la puissance associée aux forces et aux couples externes qui modifient l’énergie cinétique de translation du centre de masse et l’énergie cinétique de rotation autour du centre de masse. Ces forces et couples ne modifient pas la forme du système.
– PW représente la puissance mécanique associée au travail effectué par l’environnement sur le système qui se traduit par une déformation du système sans modification de son état de mouvement, en particulier de son énergie cinétique.
– PQ représente la puissance thermique associée à l’échange de chaleur avec l’environnement par conduction.
– PC représente la puissance chimique associée à l’échange de matière avec l’environnement par convection.
Tout processus physique effectuant un travail est appelé action mécanique. Tout processus physique au cours duquel de la chaleur est échangée est appelé transfert de chaleur. Un processus physique au cours duquel de la matière est échangée est appelé transfert de matière ou transfert de masse. Lorsqu’un transfert de chaleur s’effectue par le biais d’un transfert de matière, il s’agit d’un transfert de chaleur par convection. Lorsqu’un transfert de chaleur se produit sans transfert de matière, il s’agit d’un transfert de chaleur par conduction. En général, un transfert de matière entraîne simultanément un transfert de chaleur par convection et par conduction. De manière générale, un transfert de matière entraîne simultanément une action mécanique et un transfert de chaleur.
Thermodynamics is based on two fundamental laws. Their justification is based on the empirical validity of their implications. In this chapter, we discuss the first law. We will present the second law in Chapter 2.
The first law of thermodynamics states that:
For every system, there is a scalar extensive state function called energy (E). When the system is isolated, the energy is conserved.
The energy conservation law is mathematically written as, E˙ = 0 (isolated system) (1.9) where E˙ ≡ dE/dt. This conservation is related to time homogeneity [9]. It implies that energy is defined up to a constant.
When the system interacts with its environment, the energy evolution results from the power of the processes exerted on the system. We distinguish four types of external processes and write [10]:
E˙ = Pext + PW + PQ + PC (open system) (1.10)
-
- Pext represents the power associated with the external forces and torques that modify the translational kinetic energy of the centre of mass and the rotational kinetic energy around the centre of mass. These forces and torques do not modify the shape of the system.
-
- PW represents the mechanical power associated with the work performed by the environment on the system that results in a deformation of the system without any change in its state of motion, in particular its kinetic energy.
-
- PQ represents the thermal power associated with heat exchange with the environment through conduction.
-
- PC represents the chemical power associated with matter exchange with the environment through convection.
Any physical process performing work is called a mechanical action. Any physical process in which heat is exchanged is called a heat transfer. A physical process in which matter is exchanged is called a matter transfer or mass transfer. When a heat transfer takes place through a matter transfer, it is called a heat transfer by convection. When a heat transfer occurs without matter transfer, it is called a heat transfer by conduction. In general, a matter transfer leads simultaneously to a mechanical action and to a heat transfer.
Source :
Ansermet, J., & Brechet, S. (2019). Principles of Thermodynamics. Cambridge: Cambridge University Press.
Source :
Edgar Gunzig, Que faisiez-vous avant le Big Bang ?, Odile Jacob, 2008.



La quantité d’énergie nécessaire à une transformation est conservée après la transformation. Toutefois, la capacité de cette quantité d’énergie à engendrer de nouvelles transformations est toujours dégradée, après toute transformation.
Il n’est pas possible de “revenir en arrière” après une transformation, à partir de l’énergie qui a permis cette transformation. Les transformations sont dites irréversibles, à moins d’un nouvel apport d’énergie. En physique, l’irréversibilité est caractérisée par l'”augmentation de l’entropie”.
Sources
L’entropie est une grandeur physique qui caractérise le degré de désorganisation d’un système. Introduite en 1865 par Rudolf Clausius, elle est nommée à partir du grec ἐντροπία / entropía (“tricherie, mauvais coup”).
WikipédiaSource :
Peter Glansdorff, Ilya Prigogine. Thermodynamic Theory of Structure, Stability and Fluctuations. Wiley-Interscience. 1971.
La première loi de la thermodynamique entraîne les conséquences intéressantes suivantes. Certaines de ces conséquences sont utilisées comme des énoncés alternatifs de la première loi de la thermodynamique.
1. L’interaction thermique dépend de la trajectoire suivie par un système et c’est une fonction de trajectoire.
2. Il existe une fonction ponctuelle, appelée énergie E, telle que la variation de celle-ci est donnée par
dE=dQ – dW (4.3)
Cette conséquence est souvent énoncée comme la première loi de la thermodynamique. On a observé que l’énergie possédée par un corps est donnée par l’équation 2.8. Par conséquent, l’équation 4.3 peut être réécrite comme suit
dE = d(PE) + d(KE) + dU = dQ – dW (4.4)
Dans de nombreux processus, le PE et le KE du système ne changent pas. L’équation 4.4 se réduit alors à
dU=dQ – dlV (4.5)
Ainsi, la première loi de la thermodynamique stipule que le changement net d’énergie d’un système est égal au transfert net d’énergie à travers les limites du système.
3. Si le système est isolé de l’environnement, il ne peut pas échanger de l’énergie sous forme de chaleur ou de travail. En d’autres termes, pour un système isolé, dQ = 0 et dW = O. Par conséquent, les équations 4.4 et 4.5 se réduisent à
dE = O ou E2 = E1 (4.6)
dU = O ou U2 = U (4.7)
où les indices 1 et 2 désignent respectivement les conditions initiales et finales du système.
En d’autres termes, l’énergie d’un système isolé est conservée, ce qui est connu sous le nom de Principe de conservation de l’énergie. Le principe de conservation de l’énergie est une autre conséquence de la première loi de la thermodynamique.
The first law of thermodynamics leads to the following interesting consequences. Some of these consequences are used as alternative statements of the first law of thermodynamics.
1. Heat interaction depends on the path followed by a system and it is a path function.
2. There exists a point function, called energy E, such that the change in it is given by
dE = dQ – dW (4.3)
Quite often this consequence is stated as the first law of thermodynamics. It was observed that the energy possessed by a body is given by Eqn.2.8. Hence, Eqn.4.3 can be rewritten as
dE = d(PE) + d(K.E) + dU = dQ – dW (4.4)
In many processes the PE and KE of the system do not change. Then Eqn.4.4 reduces to
dU = dQ – dlV (4.5)
Thus the first law of thermodynamics states that the net change in the energy of a system is equal to the net energy transfer across the boundary of the system.
3. If the system is isolated from the surroundings, it cannot exchaoge energy as heat as well as work. That is, for an isolated system dQ = 0 and dW = O. Hence, Eqos.4.4 and 4.5 reduce to
dE = O or E2 = E1 (4.6)
dU = O or U2 = U1 (4.7)
where the subscripts 1 and 2 denote the initial and final conditions of the system, respectively.
In other words, the energy of an isolated system is conserved which is known as the Principle of conservation of energy. The principle of conservation of energy is another consequence of the first law of thermodynamics.
Source :
Y. V. C. Rao, Chemical Engineering Thermodynamics, Universities Press, 1997.
Source :
Luc Valentin, L’Univers mécanique. Introduction à la physique et à ses méthodes, Hermann, 1983 – 1995.
Classiquement, ce principe, souvent appelé principe de Carnot (1824), et qui a été formulé de diverses façons (Kelvin (1853) [6], Clausius (1865) [7]), concerne les échanges d’énergie dans les machines thermiques. Le 1er Principe, dit de la conservation de l’énergie, ayant énoncé l’équivalence des différentes formes d’énergie et la possibilité de transformations de l’une dans l’autre avec les lois de conservation qui régissent ces transformations, le 2e Principe établit une hiérarchie dans la qualité des différentes formes d’énergie. Les transformations d’une forme à une autre ne peuvent se faire que par des échanges d’énergie entre différents systèmes — ou parties d’un même système —. Ces échanges s’accompagnent toujours d’une perte, en ce sens qu’une partie de l’énergie est transformée en chaleur sans qu’il soit possible de retransformer la totalité de la chaleur disponible en une autre forme d’énergie.
Pour Kelvin [6], le 2e Principe est ainsi un principe de dégradation de l’énergie : toutes les formes d’énergies, bien que transformables les unes en les autres, ne sont pas au même “niveau”, du point de vue de leur utilisation et de leur transformation en travail dans une machine. La chaleur apparaît donc ainsi comme une forme particulière d’énergie en ce qu’elle en est la forme la plus “dégradée” : dans un cycle de transformations il est toujours possible de transformer intégralement de l’énergie mécanique, chimique, électrique, en chaleur mais non l’inverse. Dans une machine thermique, il faut en effet disposer, en plus d’une source de chaleur, d’un “puits” de chaleur, c’est-à-dire d’un corps à température plus basse, susceptible de recevoir une certaine quantité de chaleur de la part du système, lieu de la transformation. Il s’agit là de la formulation du 2e Principe par Clausius [7], suivant laquelle il est impossible de tirer de la chaleur d’un réservoir de façon à la transformer totalement en travail dans un processus cyclique, sans faire passer en même temps une certaine quantité de chaleur d’un corps chaud à un corps froid. Ce principe établit ainsi une asymétrie et une direction dans les échanges d’énergie : un système isolé, laissé à lui-même est le siège de transformations énergétiques qui tendent à s’orienter dans une même direction, à savoir la transformation en chaleur de la totalité de l’énergie initialement disponible pour produire du travail ; chaque fois que du travail est effectivement produit, ce n’est possible que moyennant une dégradation irréversible en chaleur d’une partie de l’énergie initialement disponible. Cette dégradation ne s’arrête que lorsque les transformations d’énergie s’arrêtent elles-mêmes, ou s’effectuent de façon rigoureusement réversible telle que les variations nettes d’état du système au cours du temps sont nulles en moyenne. On dit alors que le système a atteint son état d’équilibre. Les états d’équilibre, ainsi définis par la condition que les variables macroscopiques caractéristiques du système ne varient pas dans le temps, sont donc caractérisés par le fait que l’énergie libre — c’est-à-dire disponible pour une transformation en travail — y atteint sa valeur minimum. Autrement dit, si U représente l’énergie interne totale du système, une variation d’énergie dU est la somme d’un terme — dW, qui exprime une variation du travail disponible, et d’un terme dQ, qui exprime une variation de chaleur emmaganisée. (W représente un travail fourni, de sorte que lorsque le travail fourni augmente d’une quantité dW, le travail disponible varie d’une quantité — dW)
dU = dQ — dW
Dans un système isolé, c’est-à-dire n’échangeant pas d’énergie avec l’extérieur, dU = 0 d’où dQ = dW, relation qui exprime le premier principe, à savoir que toute production de travail est équivalente à une production de chaleur. Mais, ce qu’ajoute le 2e Principe, est que, dans le système isolé laissé à lui-même, ces transformations ne peuvent se faire finalement que dans une seule direction, celle du travail en chaleur, car la chaleur produite dans une transformation ne pourra pas être retransformée en travail sans intervention extérieure.
Source :
Henri Atlan, L’organisation biologique et la théorie de l’information, Seuil, 2006.
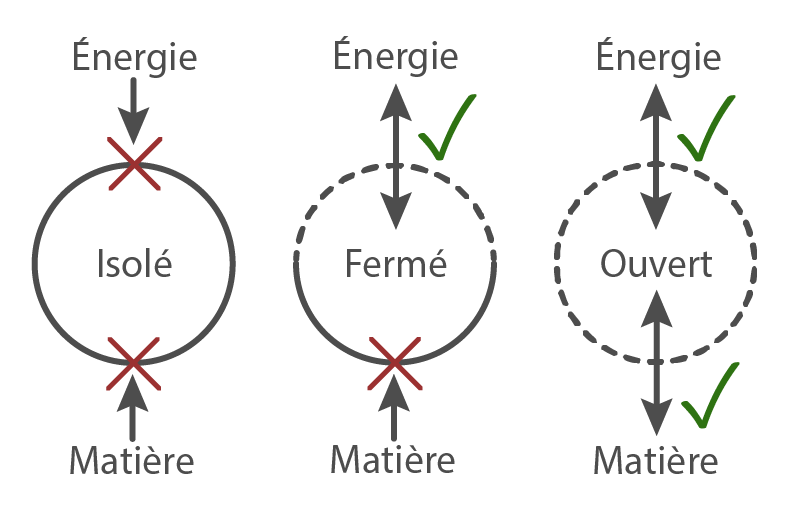
Un système physique est considéré “ouvert”, s’il entretient des échanges d’énergie et de matière avec son milieu. Il est considéré “fermé” s’il n’échange que de l’énergie avec son milieu. Il est considéré “isolé”, s’il n’échange ni matière, ni énergie avec son milieu.
La définition des limites (de la frontière) des systèmes physiques est toujours arbitraire, elle dépend des choix opérés par les humains qui les étudient.
Sources
Un système physique est une partie de l’Univers physique, choisie pour son analyse. Les systèmes physiques n’existent pas dans la nature, ce sont des constructions de l’esprit humain pour la modélisation et l’analyse des phénomènes physiques. Comme tout système en général, un système physique se caractérise par sa frontière qui distingue ses constituants internes de son environnement externe ; s’il n’est pas isolé, le système physique peut interagir avec son environnement.
Wikipédia(…)
Par conséquent, les limites du système peuvent changer de forme et de taille au cours d’un processus donné. En d’autres termes, une frontière de système peut subir un changement de configuration. De même, les limites d’un système peuvent être réelles ou imaginaires. Un système peut être aussi simple qu’une certaine quantité de gaz confinée dans un ensemble piston-cylindre ou très complexe, comme une usine pétrochimique complète. Il convient de noter qu’un système thermodynamique contient une quantité définie de matière. Pour souligner ce fait, un système est parfois appelé masse de contrôle. Un système entouré d’une frontière qui ne permet pas l’échange d’énergie sous forme de chaleur ou de travail est appelé système isolé.
Toute matière extérieure au système constitue l’environnement. La combinaison du système et de l’environnement est appelée l’univers. Dans l’analyse thermodynamique, notre intérêt est de déterminer le changement dans l’énergie et les propriétés (ou l’état) du système lorsqu’il échange de l’énergie avec son environnement. Lorsqu’un système subit un changement, ses effets ne sont visibles que dans son environnement immédiat. À une distance éloignée du système, les effets ne sont pas ressentis et il est donc nécessaire, pour des raisons pratiques, de n’inclure que l’environnement immédiat dans l’analyse thermodynamique.
(…)
Therefore, the system boundary may change in shape as well as in size during a given process. That is, a system boundary may undergo a change in configuration. Similarly, a system boundary may be real or imaginary. A system can be as simple as a certain amount of gas confined in a piston-cylinder assembly or it can be very complex such as a complete petrochemical plant. It should be noted that a thermodynamic system contains a definite quantity of matter. To emphasize this fact sometimes a system is referred to as a control mass. A system enclosed by a boundary wbich does not allow the exchange of energy in the form of heat as well as work is called an isolated system.
All matter external to the system constitutes the surroundings. The combination of system and surroundings is called the universe. In thermodynamic analysis our interest lies in determining the change in the energy and the properties (or the state) of the system when it exchanges energy with its surroundings. Whenever a system undergoes a change, its effects are seen in the immediate surroundings only. At a distance far removed from the system, the effects are not felt and hence for all practical purposes it is necessary to include only the immediate sunoundings in thermodynamic analysis.
Source :
Y. V. C. Rao, Chemical Engineering Thermodynamics, Universities Press, 1997.
La considération du système fermé était certes commode pour mieux identifier le concept de fonction d’état et pour nous proposer une hypothèse limite de prédiction de l’évolution structurelle de l’objet modélisé vers un état unique et stable. Mais elle était et demeure notoirement irréaliste. Quoi qu’en pensent les intégristes du cartésianisme, les objets susceptibles d’être légitimement modélisés par des systèmes fermés sont bien rares. Tout au plus peut-on, par passage à la limite, considérer de petites plages dans la trajectoire d’un objet donné, au sein desquelles les simplifications de la fermeture permettraient d’amorcer une modélisation. Ce cas limite ne sera même plus admissible si l’on est fondé à identifier, parmi les acteurs intervenant dans le système, un générateur inépuisable de variété (ou d’entropie négative) apportant en permanence matière, énergie (le soleil ?) ou information (l’être humain ?).
Source :
Jean-Louis Le Moigne, La théorie du système général : Théorie de la modélisation, PUF, 1994.
Pages 50 à 54 de “The Evolution of Physics” :
Il fut rapidement reconnu que ces types d’énergie, mécanique et thermique, ne sont que deux de ses nombreuses formes. Tout ce qui peut être converti en l’une ou l’autre de ces formes d’énergie est également une forme d’énergie. Le rayonnement du soleil est de l’énergie, car une partie est transformée en chaleur sur la terre. Un courant électrique possède de l’énergie, car il chauffe un fil ou fait tourner les roues d’un moteur. Le charbon représente de l’énergie chimique, libérée sous forme de chaleur lorsque le charbon brûle. Dans chaque événement de la nature, une forme d’énergie est convertie en une autre, toujours à un taux de change bien défini. Dans un système fermé, isolé des influences extérieures, l’énergie est conservée et se comporte donc comme une substance. La somme de toutes les formes d’énergie possibles dans un tel système est constante, même si la quantité de l’une d’entre elles peut varier. Si nous considérons l’univers entier comme un système fermé, nous pouvons fièrement annoncer, avec les physiciens du XIXe siècle, que l’énergie de l’univers est invariante, qu’aucune partie ne peut jamais être créée ou détruite.
Pages 89 et 90 :
[Étude du fonctionnement d’une batterie]
Pour tenter de sauver la théorie des fluides, on peut supposer qu’une force constante agit pour régénérer la différence de potentiel et provoquer un écoulement de fluide électrique. Mais l’ensemble du phénomène est étonnant du point de vue de l’énergie. Une quantité notable de chaleur est générée dans le fil qui transporte le courant, suffisamment même pour faire fondre le fil s’il est fin. Il y a donc création d’énergie thermique dans le fil. Mais l’ensemble de la pile voltaïque forme un système isolé, puisqu’aucune énergie extérieure n’est fournie. Si nous voulons sauver la loi de conservation de l’énergie, nous devons trouver où les transformations ont lieu et à quel prix la chaleur est créée. Il n’est pas difficile de se rendre compte que des processus chimiques complexes ont lieu dans la pile, processus dans lesquels le cuivre et le zinc immergés, ainsi que le liquide lui-même, jouent un rôle actif. Du point de vue de l’énergie, voici la chaîne de transformations qui se produit : énergie chimique à énergie du fluide électrique qui circule, c’est-à-dire le courant à chaleur. Une pile voltaïque ne dure pas éternellement ; les changements chimiques associés au flux d’électricité rendent la pile inutilisable au bout d’un certain temps. L’expérience qui a révélé les grandes difficultés d’application des idées de la mécanique doit sembler étrange à ceux qui l’entendent pour la première fois.
Pages 89 et 90 :
In an attempt to save the fluid theory, we may assume that some constant force acts to regenerate the potential difference and cause a flow of electric fluid. But the whole phenomenon is astonishing from the standpoint of energy. A noticeable quantity of heat is generated in the wire carrying the current, even enough to melt the wire if it is a thin one. Therefore, heat-energy is created in the wire. But the whole voltaic battery forms an isolated system, since no external energy is being supplied. I f we want to save the law of conservation of energy we must find where the transformations take place, and at what expense the heat is created. It is not difficult to realize that complicated chemical processes are taking place in the battery, processes in which the immersed copper and zinc, as well as the liquid itself, take active parts. From the standpoint of energy this is the chain of transformations which are taking place: chemical energy->energy of the flowing electric fluid, i.e., the current->heat. A voltaic battery does not last for ever; the chemical changes associated with the flow of electricity make the battery useless after a time.
The experiment which actually revealed the great difficulties in applying the mechanical ideas must sound strange to anyone hearing about it for the first time.
Source :
Albert Einstein, The Evolution of physics, Touchstone, 1967
Si le système n’est pas regardé comme complètement isolé, il est probable que l’expression rigoureusement exacte de son énergie interne devra dépendre de l’état des corps extérieurs.
Source :
Henri Poincaré, La Science et l’hypothèse, Flammarion, 2014.

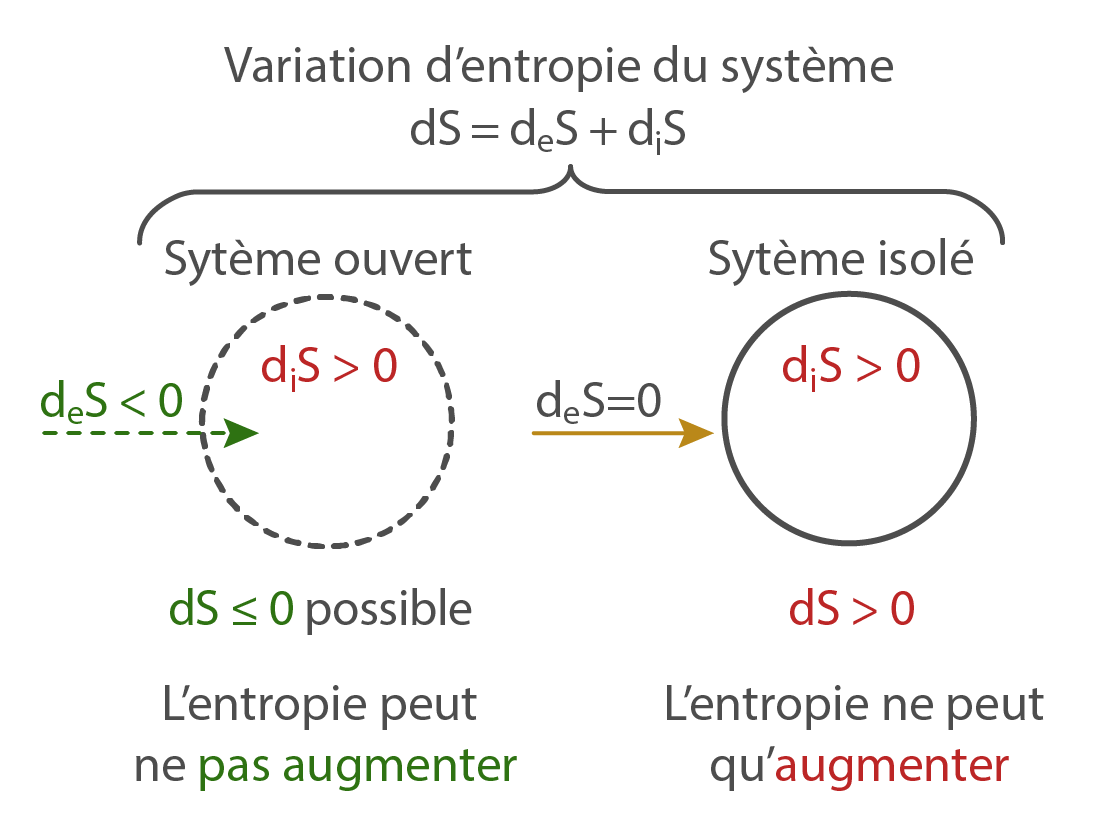

Bien que toute transformation augmente l’entropie, certains systèmes possédant des propriétés singulières peuvent entretenir et stabiliser des processus de transformation. Ils constituent alors des structures dissipatives, qui sont des cas particuliers parmi les systèmes ouverts : non seulement les structures dissipatives échangent de l’énergie avec leur milieu, mais elles ont aussi la capacité de convertir l’énergie qui les traverse en flux d’entropie, ou flux organisateur.
L’entropie interne d’une structure dissipative n’augmente pas, cependant l’entropie du milieu avec lequel ce type de système interagit augmente. Les sociétés humaines constituent des structures dissipatives : elles sont dotées de la capacité à entretenir des transformations, elles sont capables de se structurer à partir d’un flux organisateur, tant que ce flux est disponible.
Il est à noter qu’aucun système physique ne peut stabiliser de processus de transformation uniquement à partir de son énergie interne, sans être ouvert sur un flux organisateur. En effet, selon Ilya Prigogine et Peter Glansdorff : “La production d’entropie diS due aux changements à l’intérieur du système n’est jamais négative” (voir source ci-dessous). Ainsi, tout système qui ne dépendrait que de son énergie interne pour s’organiser subirait une “augmentation de son entropie”, c’est-à-dire une dégradation irréversible de ses capacités à entretenir des transformations.
Sources
Un système dissipatif (ou structure dissipative) est un système qui opère dans un environnement avec lequel il échange de l’énergie ou de la matière. C’est donc un système ouvert qui opère loin de l’équilibre thermodynamique. Un système dissipatif est caractérisé par la balance de ses échanges (ingestion d’énergie, création d’entropie), et l’apparition spontanée d’une brisure de symétrie spatiale (anisotropie) qui peut quelquefois résulter en une structure complexe chaotique. Le nouvel état du système est stabilisé grâce à sa “consommation” d’énergie issue de l’environnement. Le terme “structures dissipatives” fut créé par Ilya Prigogine.
WikipédiaIntroduction aux travaux de Peter Glansdorff et Ilya Prigogine sur les systèmes dissipatifs :
Selon Peter Glansdorff et Ilya Prigogine, l’entropie est une valeur qui ne peut, par défaut, qu’augmenter, que l’objet observé soit un système théorique isolé, un système fermé ou ouvert. Dans le chapitre III de leur étude, les auteurs explorent les conditions d’existence de systèmes particuliers, dotés de processus estimés “réversibles”. Certains systèmes, dans certaines conditions, sont susceptibles de ne pas subir l’entropie. Ils sont alors dans un état qualifié d’”éloigné de leur équilibre thermodynamique”.
Les expériences décrites montrent que “Dans de nombreuses situations, les conditions limites imposées au système l’empêchent d’atteindre l’équilibre”. Les auteurs envisagent également que, dans certaines conditions d’interaction avec le milieu, non seulement certains systèmes voient leur état être maintenu stable mais que “des propriétés entièrement nouvelles” apparaissent dans ces systèmes. Chapitre V, les auteurs précisent encore que pour tout système non isolé (établissant des interactions avec son milieu) estimé stable, toute variation de son entropie doit être compensée par un flux d’entropie provenant de l’extérieur du système considéré.
Ils complètent ensuite leur développement dans le chapitre VII, en résumant l’ensemble des conditions estimées nécessaires à l’existence de systèmes stables dotés de propriétés nouvelles, qu’ils nomment “systèmes dissipatifs” : le système doit “échanger de la matière et de l’énergie avec le monde extérieur” selon “des lois cinétiques non linéaires spécifiques” qui le maintiennent “loin de son état d’équilibre thermodynamique”.
Peter Glansdorff et Ilya Prigogine concluent leur étude sur des questionnements plus généraux, introduits par leur description des conditions nécessaires à l’apparition, dans l’évolution, des structures dissipatives. Les résultats de leur étude leur font conclure qu’un seul type de loi physique permet de décrire des situations thermodynamiques différentes : proches et éloignées de l’équilibre (extrait 1). Dans la première situation, la désorganisation de la structure est irrémédiable, dans la seconde, des structures de plus en plus complexes peuvent apparaître. Les auteurs soulignent qu’un des aspects intéressants de leur étude est que “l’apparition d’une structure dissipative dépend de ses interrelations, que cette apparition dépend des conditions et que celles-ci peuvent à leur tour être modifiées par la structure” (extrait 2). Peter Glansdorff et Ilya Prigogine définissent dans l’ensemble des systèmes ouverts particuliers, dont les propriétés leurs permettent de s’organiser (de réduire leur entropie interne) à partir d’échanges d’énergie avec leur milieu extérieur (flux d’entropie, ou flux organisateur), en excluant toute réduction d’entropie, tout possibilité d’organisation à partir de la dissipation de leur énergie interne (extrait 3).
Extraits de “Peter Glansdorff, Ilya Prigogine. Thermodynamic Theory of Structure, Stability and Fluctuations. Wiley-Interscience. 1971.” :
Pour toutes ces situations diverses, la deuxième loi de la thermodynamique reste toujours valable.
For all these various situations, the second law of thermodynamics still remains valid.
dS = diS + deS (2.1)
(b) La production d’entropie diS due aux changements à l’intérieur du système n’est jamais négative.
diS ≥ 0 (2.2)
(…)
Pour un système isolé, le flux d’entropie est par définition égal à zéro et les équations (2.1), (2.2), se réduisent à la formulation classique de la seconde loi
diS ≥ 0 (système isolé) (2.5)
Cette inégalité établit que l’entropie d’un système isolé ne peut jamais diminuer.
(…)
À ce stade, le système qui nous intéresse peut être ouvert ou fermé. Un système fermé peut échanger de l’énergie mais pas de matière avec le monde extérieur.
dS = diS + deS (2.1)
(b) The entropy production diS due to changes inside the system is never negative
diS ≥ 0 (2.2)
(…)
For an isolated system, the entropy flow is by definition equal to zero and equations (2.1), (2.2), reduce to the classical formulation of the second law
diS ≥ 0 (isolated system) (2.5)
This inequality states the entropy of an isolated system can never decrease.
(…)
So far, the system of interest may be open or closed. A closed system may exchange energy but not matter with the outside world.
Source :
Peter Glansdorff, Ilya Prigogine. Thermodynamic Theory of Structure, Stability and Fluctuations. Wiley-Interscience. 1971.
Pages 37 et 40 de “Qu’est-ce que la vie ?” :
LE MODE D’ATTAQUE DU SUJET PAR LE PHYSICIEN CLASSIQUE
Cogito ergo sum. DESCARTES
(…)
Au fait, en dépit de la variété des matières à considérer, tout cet essai se résume à mettre l’accent sur une seule notion un simple commentaire sur un problème aussi vaste qu’important. Afin de ne pas nous écarter de notre but, il est peut-être utile d’esquisser d’avance, à grands traits, notre plan.
La question vaste, importante et très discutée, est la suivante :
Comment peut-on expliquer à l’aide de la physique et de la chimie les événements qui se produisent dans l’espace et dans le temps dans les limites spatiales d’un organisme vivant ?
(…)
Pages 41 et 42 :
(…)
Les arrangements des atomes dans les parties les plus vitales d’un organisme et leurs réactions réciproques se différencient d’une manière fondamentale de tous les arrangements d’atomes qui ont été, jusqu’à ce jour, l’objet des recherches expérimentales et théoriques des physiciens et des chimistes. Et pourtant cette différence, que je viens d’appeler fondamentale, est d’une telle nature qu’elle pourrait aisément apparaître comme superficielle à tout autre qu’un physicien pénétré de la certitude que les lois de la physique et de la chimie sont entièrement statistiques. Car c’est du point de vue statistique que la structure des parties vitales des organismes vivants diffère intégralement de celle de toute autre espèce de matière que nous, physiciens et chimistes, avons jamais manipulées physiquement dans nos laboratoires ou mentalement devant notre table de travail. Il est quasi impossible d’imaginer que les lois et les régularités découvertes de cette façon pourraient s’appliquer immédiatement au comportement de systèmes qui n’exhibent pas la structure sur laquelle ces lois et ces régularités sont basées.
(…)
Pages 168 et 169 :
(…)
56. La matière vivante évite la décomposition vers l’équilibre.
Quel est le trait caractéristique de la vie ? Quand dit-on qu’une portion de matière est vivante ? Quand elle ne cesse de « faire quelque chose », de se mouvoir, d’échanger des matériaux avec le milieu environnant, et ainsi de suite, et cela pendant une période beaucoup plus longue que nous supposerions une substance inanimée capable de se maintenir en état de mouvement dans des circonstances analogues. Quand un système non vivant est isolé ou placé dans un milieu uniforme, tout mouvement cesse en général assez vite en conséquence des diverses espèces de frictions ; les différences de potentiel électrique ou chimique sont égalisées ; des substances tendant à entrer en combinaison chimique obéissent à cette tendance ; la température devient uniforme par suite de la conduction de la chaleur. En fin de compte le système tout entier se réduit à une portion de matière inerte, morte. Un état permanent est atteint où l’on n’observe plus aucun événement. Le physicien appelle cela l’état d’équilibre thermodynamique, ou d’ « entropie maxima ».
(…)
Pages 170 à 172 :
(…)
57. Elle se nourrit d’entropie négative.
C’est en évitant la décomposition rapide vers un état inerte « d’équilibre » qu’un organisme apparaît si énigmatique ; à tel point que depuis les temps les plus lointains de la pensée humaine on a prétendu – et l’on prétend encore de nos jours dans certains milieux — qu’une force spéciale non- physique, surnaturelle (vis viva, entéléchie) opérait sur l’organisme.
Comment l’organisme vivant retarde-t-il la décadence ? La réponse est évidente : en mangeant, buvant, respirant et (dans le cas des plantes) en assimilant. Le terme technique est métabolisme. Le mot grec (μεταβάλλω) signifie changer ou échanger. De quel échange s’agit-il ? A l’origine l’idée sous-entendue est sans doute un échange de substance. (Ainsi le mot allemand pour métabolisme est Stoffwechsel.) Que l’échange de matière puisse être la chose essentielle est une absurdité. N’importe quel atome d’azote, d’oxygène, de soufre, etc., vaut autant que n’importe quel autre de son espèce : que pourrait-on gagner par un pareil échange ? Pendant un certain temps, dans le passé, on satisfit notre curiosité en nous disant que nous consommions de l’énergie. Dans un certain pays très progressiste (j’ai oublié si c’était l’Allemagne ou les Etats-Unis, ou les deux), on pouvait trouver dans les restaurants des cartes de menus indiquant, en sus du prix, le contenu énergétique de chaque plat. Il est inutile de dire que, pris littéralement, cela est tout aussi absurde. Pour un organisme adulte le contenu énergétique est aussi stationnaire que le contenu matériel. Comme, incontestablement, une calorie quelconque vaut autant qu’une autre, on ne voit pas comment un simple échange pourrait servir.
Quel est donc ce précieux quelque chose, incorporé à notre nourriture, qui nous sauve de la mort ? La réponse est facile.
Tout processus, ou événement, ou développement — appelez-le comme vous voulez – en un mot tout ce qui se passe dans la nature, signifie un accroissement de l’entropie de la partie du monde où l’événement se produit. Ainsi, un organisme vivant accroit constamment son entropie ou, pourrait-on dire, crée de l’entropie positive— et ainsi tend à se rapprocher de l’état dangereux d’entropie maxima, qui est la mort. Il ne peut s’en maintenir éloigné, c’est-à-dire rester en vie, qu’en soutirant continuellement au milieu environnant de l’entropie négative, ce qui est en réalité quelque chose de très positif, comme nous allons le voir immédiatement. Donc, un organisme se « nourrit » d’entropie négative. En d’autres termes, pour nous exprimer moins paradoxalement, la chose essentielle en métabolisme est que l’organisme réussisse à se débarrasser de toute l’entropie qu’il ne peut s’empêcher de produire tant qu’il vit.
(…)
Pages 175 à 177 :
(…)
60. Organisation maintenue par extraction d’ « ordre » du milieu environnant.
Comment pourrions-nous exprimer en fonction de la théorie statistique la merveilleuse faculté que possède un organisme vivant de ralentir sa chute vers l’équilibre thermodynamique, la mort ? Nous l’avons déjà dit : « Il se nourrit d’entropie négative », comme s’il attirait vers lui un courant d’entropie négative afin de compenser l’accroissement d’entropie qu’il produit en vivant et se maintenir ainsi à un niveau d’entropie stationnaire et suffisamment bas. Si D est une mesure de désordre, sa réciproque, 1/D, peut être considérée comme une mesure directe de l’ordre. Comme le logarithme de 1/D est justement le logarithme de D pris en signe contraire, nous pourrons écrire l’équation de Boltzmann sous la forme :
— (entropie) = k log (1/D).
Ainsi, l’expression peu commode d’ « entropie négative » peut être remplacée par une meilleure : l’entropie, précédée du signe négatif, est elle-même une mesure d’ordre. Ainsi le mécanisme grâce auquel un organisme se maintient stationnaire à un niveau assez élevé d’ordre (= niveau assez bas d’entropie) consiste réellement en ce qu’il absorbe continûment de l’ordre, à partir du milieu environnant. Cette conclusion est moins paradoxale qu’elle ne le paraît à première vue. On pourrait plutôt lui reprocher d’être banale. En effet, dans le cas des animaux supérieurs, nous connaissons assez bien le type d’ordre dont ils se repaissent, notamment l’état extrêmement bien ordonné de la matière dans les composés organiques plus ou moins complexes qui leur servent d’aliments. Après s’en être servis, ils les rendent sous une forme très dégradée mais pas complètement pourtant, puisque les plantes peuvent encore les utiliser. Celles-ci, bien entendu, reçoivent de la lumière solaire leur puissante provision d’ « entropie négative ».
(…)
Pages 181 et 182 :
61. Nouvelles lois à envisager pour l’organisme.
Ce que je désire mettre en lumière dans ce dernier chapitre c’est, en abrégé, que tout ce que nous avons appris au sujet de la structure de la matière vivante doit nous préparer à la voir fonctionner d’une manière irréductible aux lois ordinaires de la physique. Et cela n’est pas dû à l’existence d’une « nouvelle force » ou autre invention qui règlerait le comportement des atomes isolés au sein d’un organisme vivant, mais parce que la construction est différente de tout ce que nous avons examiné jusqu’ici dans les laboratoires de physique. Pour l’exprimer simplement, imaginons un ingénieur qui serait familiarisé uniquement avec les machines à vapeur. Après avoir inspecté la construction d’un moteur électrique il sera disposé à admettre que ce dernier fonctionne d’après des principes qu’il ne comprend pas encore. Il constatera que le cuivre qu’il rencontre dans les chaudières est utilisé ici sous forme de fils très longs enroulés en bobine ; le fer qui lui est familier dans les leviers, dans les barres et les cylindres à vapeur, remplit ici l’intérieur de ces bobines de fil de cuivre. Il sera convaincu que c’est le même cuivre et le même fer, qu’ils sont soumis aux mêmes lois de la nature ; et il ne se trompera pas en cela. La différence de construction est suffisante pour lui faire présumer que le fonctionnement est entièrement autre. Il n’imaginera pas que le moteur électrique est actionné par un démon parce qu’on peut le mettre en marche simplement en tournant un conjoncteur, sans qu’il y ait ni chaudière ni vapeur.
Source :
Erwin Schrödinger, Qu’est-ce que la vie ? De la physique à la biologie, Points sciences, 1993.
Texte original :
CHAPTER I
The Classical Physicist’s Approach to the Subject
Cogito ergo sum. DESCARTES
THE GENERAL CHARACTER AND THE PURPOSE OF THE INVESTIGATION
(…)
For actually, in spite of the variety of topics involved, the whole enterprise is intended to convey one idea only – one small comment on a large and important question. In order not to lose our way, it may be useful to outline the plan very briefly in advance.
The large and important and very much discussed question is:
How can the events in space and time which take place within the spatial boundary of a living organism be accounted for by physics and chemistry?
(…)
Pages 4 et 5 :
(…)
The arrangements of the atoms in the most vital parts of an organism and the interplay of these arrangements differ in a fundamental way from all those arrangements of atoms which physicists and chemists have hit her to made the object of their experimental and theoretical research. Yet the difference which I have just termed fundamental is of such a kind that it might easily appear slight to anyone except a physicist who is thoroughly imbued with the knowledge that the laws of physics and chemistry are statistical throughout. For it is in relation to the statistical point of view that the structure of the vital parts of living organisms differs so entirely from that of any piece of matter that we physicists and chemists have ever handled physically in our laboratories or mentally at our writing desks. It is well-nigh unthinkable that the laws and regularities thus discovered should happen to apply immediately to the behaviour of systems which do not exhibit the structure on which those laws and regularities are based.
(…)
Page 69 :
(…)
LIVING MATTER EVADES THE DECAY TO EQUILIBRIUM
What is the characteristic feature of life? When is a piece of matter said to be alive? When it goes on ‘doing something’, moving, exchanging material with its environment, and so forth, and that for a much longer period than we would expect an inanimate piece of matter to ‘keep going’ under similar circumstances. When a system that is not alive is isolated or placed in a uniform environment, all motion usually comes to a standstill very soon as a result of various kinds of friction; differences of electric or chemical potential are equalized, substances which tend to form a chemical compound do so, temperature becomes uniform by heat conduction. After that the whole system fades away into a dead, inert lump of matter. A permanent state is reached, in which no observable events occur. The physicist calls this the state of thermodynamical equilibrium, or of ‘maximum entropy’.
(…)
Pages 70 et 71 :
IT FEEDS ON ‘NEGATIVE ENTROPY’
It is by avoiding the rapid decay into the inert state of ‘equilibrium’ that an organism appears so enigmatic; so much so, that from the earliest times of human thought some special non-physical or supernatural force (vis viva, entelechy) was claimed to be operative in the organism, and in some quarters is still claimed.
How does the living organism avoid decay? The obvious answer is: By eating, drinking, breathing and (in the case of plants) assimilating. The technical term is metabolism. The Greek word (μεταβάλλω) means change or exchange. Exchange of what? Originally the underlying idea is, no doubt, exchange of material. (E.g. the German for metabolism is Stoffwechsel.) That the exchange of material should be the essential thing is absurd. Any atom of nitrogen, oxygen, sulphur, etc., is as good as any other of its kind; what could be gained by exchanging them? For a while in the past our curiosity was silenced by being told that we feed upon energy. In some very advanced country (I don’t remember whether it was Germany or the U.S.A. or both) you could find menu cards in restaurants indicating, in addition to the price, the energy content of every dish. Needless to say, taken literally, this is just as absurd. For an adult organism the energy content is as stationary as the material content. Since, surely, any calorie is worth as much as any other calorie, one cannot see how a mere exchange could help.
What then is that precious something contained in our food which keeps us from death? That is easily answered. Every process, event, happening – call it what you will; in a word, everything that is going on in Nature means an increase of the entropy of the part of the world where it is going on. Thus a living organism continually increases its entropy – or, as you may say, produces positive entropy – and thus tends to approach the dangerous state of maximum entropy, which is death. It can only keep aloof from it, i.e. alive, by continually drawing from its environment negative entropy – which is something very positive as we shall immediately see. What an organism feeds upon is negative entropy. Or, to put it less paradoxically, the essential thing in metabolism is that the organism succeeds in freeing itself from all the entropy it cannot help producing while alive.
(…)
Pages 73 et 74 :
(…)
ORGANIZATION MAINTAINED BY EXTRACTING ‘ORDER’ FROM THE ENVIRONMENT
How would we express in terms of the statistical theory the marvellous faculty of a living organism, by which it delays the decay into thermodynamical equilibrium (death)? We said before: ‘It feeds upon negative entropy’, attracting, as it were, a stream of negative entropy upon itself, to compensate the entropy increase it produces by living and thus to maintain itselfon a stationary and fairly low entropy level.
If D is a measure of disorder, its reciprocal, 1/D, can be regarded as a direct measure of order. Since the logarithm of 1/D is just minus the logarithm of D, we can write Boltzmann’s equation thus:
– (entropy) = k log (1/D).
Hence the awkward expression ‘negative entropy’ can be replaced by a better one: entropy, taken with the negative sign, is itself a measure of order. Thus the device by which an organism maintains itself stationary at a fairly high level of orderliness ( = fairly low level of entropy) really consists in continually sucking orderliness from its environment. This conclusion is less paradoxical than it appears at first sight. Rather could it be blamed for triviality. Indeed, in the case of higher animals we know the kind of orderliness they feed upon well enough, viz. the extremely well-ordered state of matter in more or less complicated organic compounds, which serve them as foods tuffs. After utilizing it they return it in a very much degraded form – not entirely degraded, however, for plants can still make use of it. (These, of course, have their most powerful supply of ‘negative entropy’ in the sunlight.)
(…)
Page 76 :
What I wish to make clear in this last chapter is, in short, that from all we have learnt about the structure of living matter, we must be prepared to find it working in a manner that cannot be reduced to the ordinary laws of physics. And that not on the ground that there is any ‘new force’ or what not, directing the behaviour of the single atoms within a living organism, but because the construction is different from anything we have yet tested in the physical laboratory. To put it crudely, an engineer, familiar with heat engines only, will, after inspecting the construction of an electric motor, be prepared to find it working along principles which he does not yet understand. He finds the copper familiar to him in kettles used here in the form of long, long wires wound in coils; the iron familiar to him in levers and bars and steam cylinders is here filling the interior of those coils of copper wire. He will be convinced that it is the same copper and the same iron, subject to the same laws of Nature, and he is right in that. The difference in construction is enough to prepare him for an entirely different way of functioning. He will not suspect that an electric motor is driven by a ghost because it is set spinning by the turn of a switch, without boiler and steam.
Source :
Schrödinger, E., & Penrose, R. (1992). What is Life?: With Mind and Matter and Autobiographical Sketches (Canto). Cambridge: Cambridge University Press. doi:10.1017/CBO9781139644129
Page 151 de “Irreversibility; or, entropy since 1905” :
L’irréversibilité ou l’entropie depuis 1905
1 Afin d’éviter les malentendus qui pourraient survenir, je tiens à préciser d’emblée que je n’ai pas l’intention, dans cette note, de suggérer que la seconde loi de la thermodynamique est en fait fausse. Ce que je souhaite suggérer, c’est que la situation logique liée à la loi de l’entropie (que j’appellerai ici “deuxième loi de la thermodynamique”) est très insatisfaisante, et qu’il en est ainsi depuis 1905.
Planck l’a formulée en analogie avec la formulation suivante de la “première loi” qui, comme on le sait, peut être formulée comme la “loi de la machine à mouvement perpétuel exclue du premier ordre” :
(I) Il n’existe pas de machine à mouvement perpétuel du premier ordre, c’est-à-dire un système physique fermé qui pompe constamment de la chaleur dans son environnement physique ou qui absorbe constamment de la chaleur de son environnement physique.
Par analogie, la loi de l’entropie (deuxième loi) peut être formulée comme suit :
(II) Il n’existe pas de machine à mouvement perpétuel, du deuxième ordre, c’est-à-dire un système physique, immergé dans un bain de chaleur, qui, en se refroidissant (ou, ce qui revient au même, en absorbant de la chaleur du bain de chaleur environnant), peut déplacer un corps lourd contre une force, augmentant ainsi son énergie potentielle ; ou, en termes terrestres, une machine qui, en se refroidissant, peut soulever un poids.
Je ne sais pas s’il existe une meilleure formulation phénoménologique de la loi de l’entropie.
Irreversibility; or, Entropy since 1905
1 To avoid misunderstandings which might arise otherwise, I wish to make clear at the outset that I do not intend, in this note, to suggest that the second law of thermodynamics is in fact false. What I wish to suggest is that the logical situation in connection with the entropy law (as I shall here call the ‘second law of thermodynamics’) is highly unsatisfactory, and that it has been so ever since 1905.
That the law is in need of a kind of phenomenological formulation had been realised long before that date; and Planck formulated it in analogy to the following formulation of the ‘first law’ which, as is well known, can be formulated as the ‘law of the excluded perpetual motion machine of the first order’ :
(I) There does not exist a perpetual motion machine of the first order; that is to say, an otherwise closed physical system which either constantly pumps heat into its physical environment, or which constantly absorbs heat from its physical environment.
The entropy law (second law) may be formulated by analogy, as follows:
(II) There does not exist a perpetual motion machine, of the second order, that is to say, a physical system, immersed in a heat bath, which, by cooling down (or, which is the same, by absorbing heat from the surrounding heat bath), can move a heavy body against a force, thus increasing its potential energy; or in terrestrial terms, a machine which, by cooling down, can lift a weight.
I am not aware that a better phenomenological formulation of the entropy law exists.
Source :
Popper, Karl R. (1957). Irreversibility; or, entropy since 1905. British Journal for the Philosophy of Science 8 (30):151-155.
L’approche de la thermodynamique basée sur la théorie des ressources qui a été explorée dans cet article est clairement centrée sur l’agent. La théorie des ressources ne cherche pas à répondre à la question de savoir si certaines conversions d’état qui peuvent être réalisées par les opérations libres se produisent également dans le cadre de la dynamique naturelle (c’est-à-dire en l’absence d’agents qui les provoquent). Néanmoins, l’approche de la théorie des ressources pourrait être adaptée à de telles questions. Plus précisément, si l’on souhaite caractériser un certain sous-ensemble d’opérations libres comme étant plus difficile à réaliser que d’autres (au motif qu’elles ne se produisent pas naturellement), il faut alors identifier les caractéristiques qui distinguent ces opérations et redéfinir l’ensemble des opérations libres pour les exclure.
The resource-theoretic approach to thermodynamics that has been explored in this article is clearly agentcentric. The question of whether some state conversion which can be achieved by the free operations also arises under natural dynamics (that is, in the absence of agents bringing them about) is not one that a resource theory seeks to answer. Nonetheless, the resource-theoretic approach might be adaptable to such questions. Specifically, if one wishes to characterize a certain subset of the free operations as more difficult to realize than others (on the grounds that they do not arise naturally), then one ought to identify the features that distinguish these operations and redefine the set of free operations to exclude them.
Source :
Gour, Gilad et al. “The resource theory of informational nonequilibrium in thermodynamics.” Physics Reports 583 (2015): 1-58.
Source :
Henri Atlan, L’organisation biologique et la théorie de l’information, Seuil, 2006.
